‘mRNA(전령RNA) 백신’이라 불리는 생소한 물질이 인류 역사상 가장 치열했던 백신 경쟁의 결승점을 먼저 통과했다. 2020년 11월 독일의 바이오엔테크와 미국의 화이자가 공동개발한 BNT162b2가, 12월 미국의 모더나와 국립알레르기·전염병연구소(NIAID)가 공동개발한 mRNA-1273이 각각 FDA 승인을 받았다. 이로써 두 종류의 mRNA 백신이 전통적인 백신들을 따돌리고 개발 속도 면에서 가장 앞서 나갔다. mRNA 백신은 또 다른 변이 바이러스가 나타나더라도 가장 빨리 새로운 백신을 만들어 대응할 수 있는 기술이기도 하다.
mRNA가 백신으로 사용된 것은 코로나19가 첫 사례이다. 그럼에도 어떻게 이토록 놀라운 성공을 거뒀을까? 이번 리포트에서는 mRNA 백신의 정의, 면역 유도 원리, 생산법, 장‧단점, 향후 전망 등에 대해 면밀히 살펴보고자 한다.
mRNA란 전령 리보핵산(messenger RNA)의 준말이다. 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 전령 역할을 한다. mRNA는 수백~수천 개의 단위체가 구슬처럼 연결된 긴 사슬 구조를 갖고 있다. 단위체에는 4종류가 있는데(A, G, C, U), 이 4종의 단위체들이 어떻게 나열되느냐에 따라 다른 유전정보를 담게 된다.
mRNA 백신은 mRNA 분자와 이를 둘러싼 지질층으로 구성된다(그림2). mRNA가 정보를 담고 있는 물질이고, 지질층은 전령(mRNA)을 보호하고 세포 안으로 넣어주는 이동장치인 셈이다. 사스코로나바이러스-2 mRNA 백신의 경우, 바이러스의 표면에 있는 스파이크단백질을 만드는 유전정보를 담고 있다. 즉, 이 mRNA가 사람의 세포로 들어가면 스파이크단백질이 생산된다. 백신에 의해 생성된 스파이크단백질은 항체 형성을 유도하는 ‘항원’으로 기능한다.
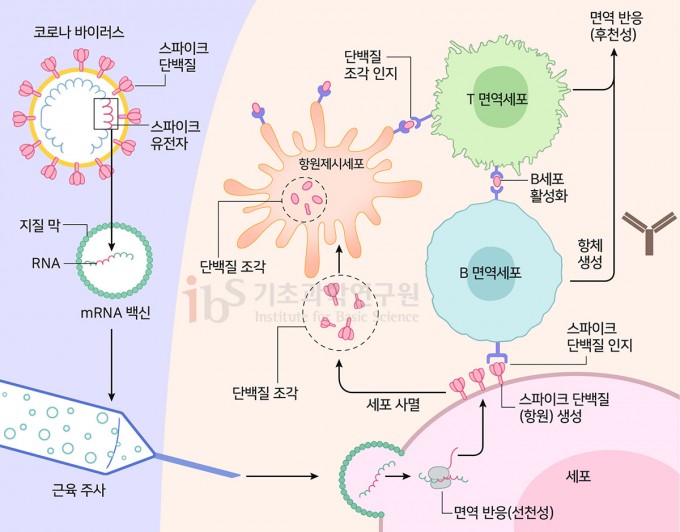
인체의 면역세포들은 인위적으로 만들어진 단백질로 인해 마치 바이러스에 감염된 상황으로 착각을 하고 스파이크단백질에 대한 항체를 만들어낸다. 항체를 만드는 B 면역세포뿐만 아니라 이를 도와주는 T 면역세포도 활성화된다. 이와 같은 반응을 ‘후천성 면역’이라 부른다. 즉, ‘간접체험’을 통해 인체는 바이러스에 대한 면역력을 얻는다. 이후에는 실제 바이러스가 몸에 들어온다고 해도 항체가 바이러스를 감싸서 감염을 막을 수 있다. 또한 세포가 바이러스에 감염돼 스파이크단백질을 만들면, 면역세포가 이 세포를 알아보고 공격해서 죽이기 때문에 바이러스의 증식을 막을 수 있다.
백신에 사용되는 mRNA는 자연적인 mRNA를 모방하여 만든 인공 RNA이다. mRNA 백신이 성공적으로 작동하려면 두 가지가 중요하다. 첫째는 자연적인 mRNA와 유사한 정도이다. 단백질을 잘 만들어내어야 하고, 진짜 바이러스의 mRNA인 것처럼 세포를 속일 수 있어야하기 때문이다. 둘째로 선천성 면역반응이 과다하게 일어나지는 않도록 해야 한다. 세포가 백신의 mRNA 자체를 침입자로 인식해 과다한 면역 반응이 일어나면 항원으로 작동할 단백질 생산에 차질이 생긴다. 면역 ‘선행학습’이 불가능하다는 의미다.
mRNA의 구조를 살펴보자(그림3). 단백질 정보를 담는 코딩서열(coding sequence)이 mRNA의 핵심이다. mRNA 백신의 경우 면역반응을 유발할 항원(코로나19 백신의 경우 스파이크단백질)을 만드는 정보를 코딩서열에 담는다. 코딩서열을 둘러싼 비번역서열(UTR·untranlated region)은 단백질 생산을 돕는다.
한편, RNA가 시작하는 쪽 끝을 5’ 말단이라고 부르는데, 여기에는 ‘캡(cap)’이라는 중요한 구조가 있다. 캡은 단백질 생산을 돕고, mRNA가 파괴되지 않도록 막아준다. 또한 mRNA가 지나친 선천성 면역반응을 일으키지 않도록 한다. 반대쪽 끝은 3’ 말단이라 한다. 여기에는 ‘폴리A꼬리(poly(A) tail)’라 부르는 중요한 구조가 있다. 단백질 생산을 돕고 mRNA를 안정적으로 유지하는 역할을 한다.
위에 설명한 구조는 자연적인 mRNA에 원래 존재하는 것들이다. mRNA 백신의 경우 RNA의 자연적인 염기 성분을 수도유리딘(pseudouridine), 메틸수도유리딘(N1-methyl-pseudouridine), 메틸사이토신(5mC)과 같은 인공적인 유도체로 교체함으로써 과다한 면역 반응을 피하고 단백질 생산이 잘 일어나도록 설계한다.
![mRNA 백신의 구조와 제조 방법. mRNA는 단백질의 정보를 담은 코딩서열, 단백질 생산을 돕는 비번역서열, mRNA가 파괴되지 않도록 막는 캡 그리고 mRNA를 안정적으로 유지하는 폴리A꼬리로 구성된다. RNA를 세포 내로 전달하기 위해 지질과 폴리에틸렌글라이콜 등을 섞어서 나노입자를 만든다. [Verbeke et al., 2019; Linares-Fernández et al., 2019]](http://image.dongascience.com/Photo/2021/01/fd600eeb15036dc8b193d184e51ab499.jpg)
mRNA 백신의 제조 방법
mRNA 백신은 여러 단계의 효소 반응을 거쳐 만들어진다(그림3). 우선 RNA를 제조하려면 거푸집(주형) 역할을 하는 DNA를 만들어야 한다. DNA에 RNA중합효소, RNA의 단위체와 캡 유사체 등을 첨가하여 반응시키면 mRNA를 만들 수 있다. 이 과정에서 mRNA의 안정성을 높이기 위해 폴리A꼬리가 생기고, 유리딘 유도체가 삽입된다. 경우에 따라 RNA 합성 이후에 캡을 붙이고 적절한 변형을 가하기도 한다. 이후 DNA와 부산물을 분해하고, 불순물을 제거하는 정제 과정을 거친다. 합성과정에서 불순물로 생기는 이중나선RNA를 방치하면 과도한 선천성 면역 반응이 일어나서 문제가 될 수 있다.
mRNA는 세포 안으로 들어가야 단백질을 만들 수 있다. 그런데 RNA는 전하를 띤데다 분자량이 커서 그 상태로는 세포막을 통과해 세포 안으로 들어갈 수 없다. 우리 몸의 RNA 분해효소에 의해 분해되지 않도록 보호 장치도 필요하다. 이 때문에 RNA를 보호하고 세포로 전달하는 기술을 개발하기 위한 노력이 오랜 시간에 걸쳐 이뤄져왔다. 현재는 지질나노입자(liquid nanoparticle) 기술이 가장 널리 쓰인다.
지질나노입자는 여러 종류의 물질을 혼합하여 만든다. 인지질과 이온화가 가능한 지질(이온화지질·ionizable lipid)은 입자의 주된 구성 성분으로 세포막과 융합해서 RNA를 전달한다. 콜레스테롤은 입자의 모양을 유지하고 세포질로 RNA가 이동하는 과정을 돕는다. 폴리에틸렌글라이콜(PEG·polyethylene glycol)은 입자의 친수성을 높이고, 지질나노입자가 체내에 오래 머무를 수 있게 도와준다. 이렇게 만들어진 지질나노입자는 보통 지름 100nm(나노미터·1nm는 10억 분의 1m) 정도로, 바이러스 입자와 비슷한 크기이다.
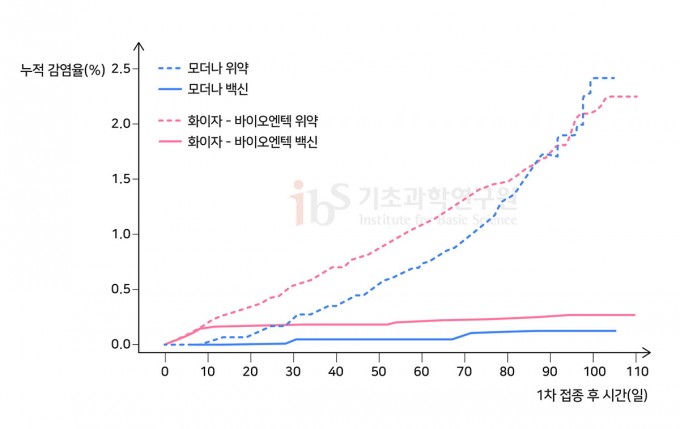
코로나19 백신의 사례에서 보았듯, mRNA 백신의 장점은 무엇보다 신속성과 유연성이다. 병원체의 유전자 정보만 알면 빠르게 설계하고 생산할 수 있다. 2020년 1월 10일 사스코로나바이러스-2의 유전자 정보가 공개된 후 모더나에서 1상 임상시험에 필요한 백신을 만드는 데 고작 25일밖에 걸리지 않았다(다른 문제로 인해 실제 임상시험은 3월 16일에 시작됐다).
게다가 이 기간은 백신 개발 플랫폼이 정비되면 더 단축할 수 있다. 어떤 신종 병원체가 등장해도 유전자 정보만 알면 한 달 이내에 백신을 만들어 임상시험에 들어갈 수 있다. 초기 개발을 위한 시간과 비용이 적게 들기 때문에 비교적 환자가 적은 감염병에 대해서도 대비할 수 있다. 또, 기존 약물(단백질이나 저분자화합물)에 비해 소규모 설비로도 생산이 가능하다. 생산 파이프라인 설계에 따라 소량부터 대량까지 생산량을 유연히 조절할 수도 있다. 여러 종류 mRNA를 생산해 혼합해서 도입하는 접근법도 가능하다.
안전성(safety)도 큰 강점이다. mRNA는 원래 우리 몸에 있는 물질이므로 그 자체로는 독성이 없다. 제조 과정에서 세포를 이용하는 대신 정제된 효소를 사용하기 때문에 위험한 불순물이 들어갈 우려도 거의 없다. 기존에 사용된 어떤 백신 종류보다 안전하다고 평가되는 이유이다. 다만 mRNA를 전달하는 지질나노입자의 성분인 폴리에틸렌글라이콜이 부작용을 일으킬 가능성이 제기되고는 있다. 하지만 코로나19 백신을 통해 평가와 검증이 광범위하게 이뤄지고 있기 때문에, 안전에 대한 우려는 곧 결론이 나올 것으로 보인다.
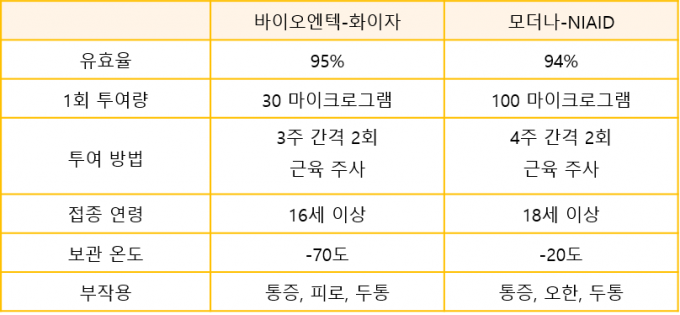
단점으로는 열안정성(thermal stability)이 꼽힌다. 다른 백신들은 4℃나 상온에서 보관할 수 있다. 그러나 모더나 백신은 냉동고에서 보관해야 하고, 화이자 백신의 경우 초저온(-70℃) 상태에서 유통해야 한다. 정제된 mRNA 자체는 상당히 안정적인 물질이지만, 지질나노입자가 불안정해서 저온 보관이 필요한 것으로 추정된다. 지질나노입자의 개선 혹은 대체 기술 개발이 관건이다.
mRNA 설계에도 개선의 여지가 크다. RNA의 구성 요소 각각에 대한 연구를 통해 RNA가 더 오래 세포에 머무르며 더 많은 단백질을 생산하도록 만들 방법을 찾아내야 한다. 과잉면역을 피하면서 적절한 면역반응을 유도할 수 있는 최선의 솔루션을 찾는 것도 필요하다. RNA 사용량을 줄일 수 있다면 가격을 낮추며 더 많은 사람에게 더 빨리, 더 안전하게 백신을 공급할 수 있을 것으로 기대된다. 실제로 현재 임상2상이 진행 중인 독일의 큐어백(Curevac)사의 mRNA 백신의 경우는 12마이크로그램으로도 효과를 나타내고 냉장으로 유통이 가능하다고 알려져 있어서, mRNA 백신 기술은 추가적 발전 여지가 큰 것으로 보인다.
mRNA는 1961년 발견 이후 반세기가 넘는 연구 끝에 인류를 감염병 위기에서 구할 강력한 도구가 되었다. 이번 코로나19 사태에서 mRNA의 안전성과 효과가 입증된 만큼, 앞으로 mRNA 백신이 감염병 예방에 널리 사용될 것이 분명하다. 사스코로나바이러스-2는 변이를 만들어가며 계속 인류를 괴롭힐 것이기 때문에, 변이 바이러스에 대한 대처에 mRNA 백신이 큰 도움을 줄 수 있다. 물론 모든 병원체에 mRNA 백신이 효과가 있으리라는 보장은 없다. 그러나 신종 병원체에 대한 대응력을 높일 가능성은 매우 크다. 그간 대책 없이 방치되었던 저개발국의 국지적 감염 사태에 해결책을 제시할 수도 있다. 이미 지카바이러스, 인플루엔자, 말라리아 등에 대한 mRNA 백신 임상시험이 진행되고 있다.
감염병 예방 백신 이외에 암 백신으로의 활용 가능성도 높다. 암 세포는 정상 세포와는 달리 비정상적인 단백질을 만들어낸다. mRNA 기반 암 백신의 투여로 암 특이적인 단백질이 체내에서 생성되면, 이후 면역세포가 암 단백질을 인지해 암세포만 선택적으로 파괴할 수 있다. 암 세포 단백질은 환자마다 다를 수 있어서 개인 맞춤형 암 백신을 개발하는 것이 바람직하다. mRNA는 설계가 비교적 쉬워 개인 맞춤형 암 백신 생산이 가능하다. 실제로 코로나19 사태 이전 mRNA 백신의 주요 타깃은 암이었고, 현재 다수의 임상시험이 진행 중이다.
mRNA는 백신을 넘어서 ‘유전자 전달체’로서 의학과 생명공학에 광범위하고 심대한 영향을 미칠 것이다. mRNA는 이론적으로는 어떤 유전자든지 우리 몸으로 전달할 수 있다. mRNA를 이용해서 우리 몸에 부족한 유전자를 도입하는 ‘유전자 치료’가 가능한 것이다. mRNA는 설계와 생산이 쉽고 빠르다. 따라서 플랫폼만 잘 갖추어 놓으면 각종 질환에 수개월 이내에 대처할 수 있다. 즉, 질환의 유전적 원인만 파악되면 이에 대응할 백신 및 치료제 개발은 비교적 쉽고 초기 개발 비용이 저렴하다. 이에 시장규모가 작아 개발이 어려웠던 희귀질환의 치료제 등장에도 희망을 걸어 볼 수 있다. 기존 약물 개발에 십년 이상의 시간과 수천억 원의 비용이 드는 것과 비교하면 혁명적 변화이다.
이러한 장밋빛 꿈이 저절로 이루어지지는 않는다. mRNA가 갖고 있는 가능성을 현실로 만들기 위해서는 더 많은 연구가 필요하며, 해야 할 일도 많다.
우선, RNA 자체에 대한 연구가 더 필요하다. RNA가 우리 몸에서 오래 머무르며 단백질을 잘 만드는 동시에 과다한 면역반응을 일으키지 않도록 해야 한다. 그러려면 지금보다 더 높은 수준에서 RNA에 대한 심층적 이해가 필요하다. 둘째, RNA 전달 기술이 더 개선되어야 한다. 우리 몸 어디로든 mRNA를 충분히 전달하려면 특정 기관과 세포로 RNA를 보내는 효율적인 기술이 필요하다. 열안정성이 높고 더 안전한 전달체 개발도 관건이다. 셋째, 질환의 유전적 원인을 정확히 알아야 한다. 그래야만 어떤 유전자를 전달해야 하는지 알 수 있다. 따라서 질환의 원인에 대한 분자유전학적 연구가 선행되어야 한다. 마지막으로 이러한 다학제적인 연구들을 유기적으로 연결할 수 있는 인적 네트워크와 물적 인프라가 필요하다. 전문 인력을 키우고, 기초연구실·병원·제약업계·정부가 긴밀히 협력하도록 돕는 시스템이 있어야 한다.
물론 쉬운 일은 아니다. 그러나 코로나19 백신이 빠르고 성공적으로 개발됐듯, 이 꿈이 이루어지는 데도 그리 긴 시간이 걸릴 것 같지 않다. 우리는 가까운 미래에 유전정보를 치료제로 곧바로 이어주는 RNA 기술을 만나게 될 것이다. 어쩌면 이는 21세기 과학이 인류에게 주는 가장 큰 선물이 될 수도 있다.
※참고문헌
Verbeke et al., Nano Today, 28:1 (2019), Three decades of messenger RNA vaccine development
Linares-Fernández et al., Trends in Molecular Medicine, 26:311 (2019), Tailoring mRNA vaccine to balance innate/adaptive immune response.
Topol, Cell, (2021), Messenger RNA vaccines against SARS-CoV-2.
Jackson et al., NPJ Vaccines 11:1 (2020), The promise of mRNA vaccines: a biotech and industrial perspective.
Polack et al., NEJM 383:2603 (2020), Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine.
Jackson et al., NEJM 383:1920 (2020), An mRNA vaccine against SARS-CoV-2 – Preliminary report.
김빛내리 기초과학연구원(IBS) RNA 연구단 단장‧서울대 생명과학부 석좌교수(RNA생물학)
※ 원문 출처 : 기초과학연구원
기초과학연구원(IBS)은 지난해에 이어 사스코로바이러스-2(SARS-CoV-2)의 과학적 이해와 극복 방안 모색을 위한 ‘코로나19 과학 리포트 2’를 연재합니다. 이번 연재에서는 최근 세계적 관심을 불러일으킨 바이러스 변이와 백신‧치료제 개발 관련 연구동향과 쟁점을 집중적으로 다룹니다. IBS 과학자들과 국내 전문가들이 전달하는 최전선의 지식과 정보가 코로나바이러스감염증-19(COVID-19, 이하 코로나19) 종식에 도움이 되기를 바랍니다.












![[人투더스페이스]](https://image.dongascience.com/Photo/2024/04/17132352853717.jpg)
![[人투더스페이스]](https://image.dongascience.com/Photo/2024/04/17128905885548.jpg)



![[표지로 읽는 과학] 식물 생존기능 '질소고정', 해양 조류에서 발견](https://image.dongascience.com/Photo/2024/04/17128989241024.png)

![[표지로 읽는 과학] 위기에 직면한 곤충](https://image.dongascience.com/Photo/2024/04/17129009098522.png)







![[사이언스게시판] 국립과천과학관, 성인과학학습 프로그램 '과학과愛' 운영 外](https://image.dongascience.com/Photo/2024/04/17133443257693.png)














![[Chapter1] 기후 재앙에 맞서다!](http://dl.dongascience.com/uploads/article/thumbnail/202404/Screenshot_2024-03-31_20.30_.56_z8Cdg4_.png)
![[Chapter2] 인류 위협하는 전염병 막는다](http://dl.dongascience.com/uploads/article/thumbnail/202404/Screenshot_2024-03-31_20.37_.02_pHcaF9_.png)
![[Chapter 3] 사회 문제의 답 찾는다!](http://dl.dongascience.com/uploads/article/thumbnail/202404/Screenshot_2024-03-31_20.41_.05_DE4XSu_.png)
![[Chapter 4] 수학자의 호기심, 별별 예측](http://dl.dongascience.com/uploads/article/thumbnail/202404/Screenshot_2024-03-31_20.41_.56_xE1HCJ_.png)
![[SF소설] 타디그레이드 피플](http://dl.dongascience.com/uploads/article/thumbnail/202404/Screenshot_2024-03-31_20.43_.47_BYUaAS_.png)
![[신의 책] 개념을 명확히 모르면 생기는 일](http://dl.dongascience.com/uploads/article/thumbnail/202404/Screenshot_2024-03-31_20.44_.11_FgRXrL_.png)

![[뉴럴링크] 뉴럴링크가 이뤄낸 혁신은 소프트웨어 아닌 하드웨어](http://dl.dongascience.com/uploads/article/thumbnail/202404/pic__2024-03-31_at_5.31_.49_PM_.png)

![[다시 쓰는 과학교과서] 표준모형 너머 우주의 근본 이론 찾는다](http://dl.dongascience.com/uploads/article/thumbnail/202404/pic__2024-03-31_at_6.16_.48_PM_.png)
![[기획] 혈당 스파이크? 기자가 직접 확인해봤습니다](http://dl.dongascience.com/uploads/article/thumbnail/202404/pic__2024-03-31_at_6.56_.24_PM_.png)
![[과학사 극장] 산소의 발견자는 라부아지에다?](http://dl.dongascience.com/uploads/article/thumbnail/202404/pic__2024-03-31_at_7.46_.54_PM_.png)
![[과학을 돕는 과학, 과학정책]연구가 잘됐는지 어떻게 평가할까?](http://dl.dongascience.com/uploads/article/thumbnail/202404/pic__2024-03-31_at_9.26_.27_PM_.png)

![[특집] 근질근질, 푸헤취~! 알레르기를 조심해](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_20.42_.02_.png)
![[기획] 소 트림을 감시하라](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_21.32_.35_.png)

![[공지] 어린이 우주인 선발대회](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_20.07_.54_.png)
![[화보] 멸종 위기 동물 사진관](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_20.39_.17_.png)
![[특집] 알레르기는 왜 생길까?](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_20.59_.54_.png)

![[이야기로 냠냠!어수잼] 몇 개 빼줄까? 소원이 방울방울](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_23.43_.49_.png)
![[특별한 수학] <어수동>독자들, 내 동료가 돼라! 둘,셋! 수학돌 어수동즈](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-15_00.13_.21_.png)

![[숫자로 보는 뉴스] 매미 오줌이 코끼리보다 빠르다?](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_23.37_.25_.png)

![[이야기로 냠냠!어수잼] 신비한 두더니 '더지니'](http://dl.dongascience.com/uploads/article/thumbnail/202408/ds_2024-04-14_23.56_.45_.png)









